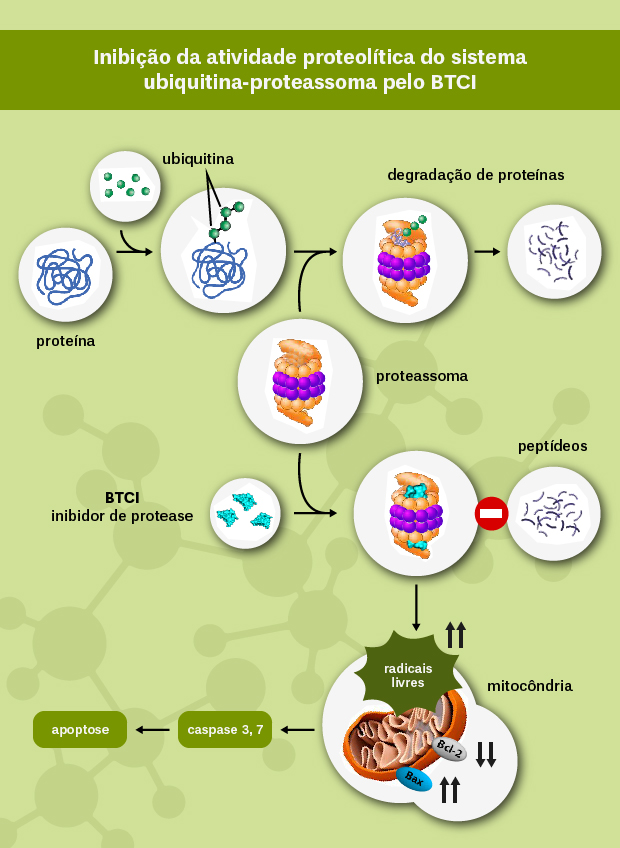
O legado do professor Aaron Ciechanover, Nobel de Química de 2004, é inegável. Ele descobriu uma molécula chamada ubiquitina, que, hoje se sabe, é responsável por regular uma série de funções celulares, como processos no nível de replicação e divisão celular. Ela exerce a função de marcar e direcionar proteínas indesejáveis para a molécula denominada proteassoma – utilizada para destruir proteínas danificadas ou com erros de síntese –, eliminando-as do sistema celular e orientando os processos vitais da célula.
“A ubiquitina regula os eventos que mantêm a dinâmica da vida”, explica a professora Sonia Maria de Freitas, coordenadora do Programa de Pós-Graduação em Biologia Molecular do Instituto de Ciências Biológicas (IB) da Universidade de Brasília. O grupo de pesquisa liderado pela docente desenvolve estudos sobre a inibição da via de degradação de proteínas no contexto do sistema de ubiquitina-proteassoma.
A proteína utilizada nos estudos da equipe – o BTCI – é inibidora de proteases, ou seja, de enzimas que hidrolisam ou quebram outras proteínas. Ela foi purificada em 1966 a partir de sementes de feijão de corda Vigna unguiculata pelo professor Emérito da UnB Manuel Mateus Ventura, orientador de doutorado de Sonia. “Trabalha-se até hoje com a caracterização estrutural e funcional do BTCI, obtido a partir dessas sementes, que são plantadas na Estação Experimental de Biologia da Universidade”, explica a coordenadora do programa.
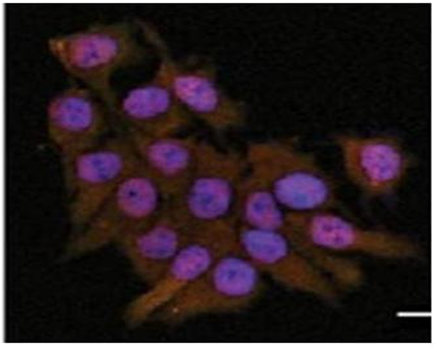
A caracterização funcional do BTCI consiste, atualmente, na investigação do efeito desta molécula contra o câncer de mama. Ela inibe a atividade de degradação de proteínas pelo proteassoma de células desse tipo de câncer, interagindo especificamente com esta molécula e induzindo a morte das células.
Essa interferência do BTCI resulta em acúmulo de proteínas não funcionais, produção de radicais livres, aumento na expressão de proteínas relacionadas à morte (BAX). Como consequência, a função mitocondrial é prejudicada e o material genético da célula tumoral é danificado. Dessa forma, outras proteases relacionadas ao processo de morte programada na célula são ativadas, resultando na morte celular.
Sonia orienta hoje três pós-doutorandos e dois doutorandos, além de mestrandos e alunos de iniciação científica, envolvendo todos os níveis da Universidade. O grupo conta, ainda, com a colaboração do professor visitante na UnB Aisel Valle Garay. “Mais de dez alunos ao longo da história do grupo desenvolveram trabalhos cujos resultados nos permitem investigar os mecanismos que levam à morte programada”, explica Azadeh Mehdad, pós-doutoranda do programa coordenado pela professora Sonia.
A perspectiva do trabalho é boa: conhecendo os mecanismos de interação entre o proteassoma e o inibidor BTCI, é possível pensar em uma droga que afete a programação de morte das células tumorais. O BTCI age como inibidor da via sinalizadora da morte programada. A célula, que já está confusa metabolicamente, fica mais ainda, uma vez que, inibindo os genes reguladores de processos metabólicos, ela morre. “Meu trabalho é justamente analisar descobrir onde e como o BTCI se liga no proteassoma e interrompe o ciclo celular, para que possamos investigar os mecanismos mais sofisticados regulados por esta molécula”, conta Luísa Meneghetti, mestranda do programa.
VACINA PARA ZIKA – O professor Tatsuya Nagata, coordenador do Programa de Pós-Graduação em Biologia Microbiana, está trabalhando no desenvolvimento de um teste para diagnosticar precisamente o vírus da zika. Hoje, o da dengue também reage ao teste e é difícil precisar qual dos vírus acomete a pessoa. A diferença entre os dois é molecular.

”Usando o conhecimento derivado da técnica do professor Aaron, queremos identificar a diferença entre os dois, tornando possível tanto modificá-lo no futuro, quanto usá-lo para o teste e a vacina”, explica o professor.
O docente participou neste ano de uma reunião no Ministério da Ciência, Tecnologia, Inovações e Comunicações (MCTIC). No encontro, identificou que há demanda pelo teste em todos os estados brasileiros, principalmente nos mais afetados por essas doenças. “Falta uma ferramenta capaz de identificar com mais precisão e eficiência”, diz.
A vacina leva cerca de dez anos para ser desenvolvida, uma vez que os testes precisam ser feitos em seres humanos. É preciso analisar a interação do vírus com o nosso cérebro para determinar o que causa a microcefalia em fetos. Segundo essa ideia, é possível determinar qual parte do ácido ribonucleico (RNA) – que corresponde à carga genética do vírus – causa a microcefalia. No caso de gestantes, não se pode utilizar a estratégia do vírus fraco, como se faz com a febre amarela, porque ainda não se identificou o quê, na carga genética do vírus, pode causar a microcefalia. “Para o feto em formação, esse contato, mesmo que enfraquecido, pode levar ao desenvolvimento da doença”, afirma Tatsuya Nagata.
O RNA gera proteínas que são utilizadas pelo nosso corpo para identificar a zika e, assim, as células de defesa são ativadas.
Se a técnica do professor puder ser aplicada em larga escala, o vírus terá seu núcleo extraído, ou seja, não terá mais as informações genéticas para replicação e ficará “oco”. É como se só sobrasse a casca do vírus, que é suficiente para que haja a identificação do vírus pelos anticorpos.
NOBEL – O cientista Aaron Ciechanover, vencedor do prêmio Nobel de Química em 2004, vem à Universidade de Brasília no próximo dia 10 de agosto. O israelense e sua equipe alcançaram o feito com um estudo que tem contribuído muito, desde então, para o tratamento individualizado contra o câncer e para a produção de medicamentos para controle e tratamento de outras doenças.
No auditório da Associação dos Docentes da UnB (ADUnB), às 11 horas, Ciechanover vai compartilhar experiências e inquietações vividas em mais de quatro décadas dedicadas à carreira científica. A participação é gratuita e aberta a quaisquer interessados.
No mesmo dia 10, às 15h, no auditório da Reitoria, o pesquisador será homenageado pela Universidade com o título de Doutor Honoris Causa.
Veja também:












